歐亞經(jīng)濟聯(lián)盟(EAEU)是一個由俄羅斯、白俄羅斯、哈薩克斯坦、亞美尼亞和吉爾吉斯斯坦組成的區(qū)域性經(jīng)濟組織。其醫(yī)療器械注冊制度基于EAEU《醫(yī)療器械流通統(tǒng)一原則協(xié)定》(2018年生效)及附屬技術法規(guī),旨在統(tǒng)一聯(lián)盟內(nèi)醫(yī)療器械的市場準入標準,確保產(chǎn)品的安全性、有效性和質(zhì)量。
一、法律框架與核心法規(guī)
EAEU醫(yī)療器械注冊的法律基礎主要包括:
- 《歐亞經(jīng)濟聯(lián)盟條約》及理事會決議;
- 《醫(yī)療器械流通統(tǒng)一原則協(xié)定》(2021年全面實施);
- 歐亞經(jīng)濟委員會(EEC)制定的技術法規(guī),如對醫(yī)療器械分類、注冊程序、技術文件、臨床評估和上市后監(jiān)督的具體要求。
二、注冊流程概述
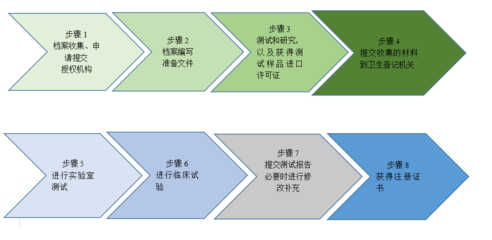
注冊流程由EAEU統(tǒng)一管理,申請者需向任一成員國的主管機構(gòu)(如俄羅斯的Roszdravnadzor)提交申請,通過后注冊證書在整個聯(lián)盟內(nèi)有效。主要步驟包括:
- 分類確定:根據(jù)風險等級(I、IIa、IIb、III類)劃分醫(yī)療器械;
- 技術文件準備:包括產(chǎn)品描述、技術規(guī)格、風險管理文件、臨床評估報告和標簽信息;
- 測試與評估:可能需要在認可實驗室進行性能和安全測試;
- 專家評審:由主管機構(gòu)或指定機構(gòu)進行文件審查和現(xiàn)場審核;
- 證書簽發(fā):注冊有效期為5-10年,可續(xù)期。
三、關鍵法律要求
- 符合性評估:必須符合EAEU統(tǒng)一技術法規(guī),包括安全性和有效性標準;
- 本地代表:非EAEU制造商需指定聯(lián)盟內(nèi)的授權代表;
- 標簽與語言:產(chǎn)品標簽和使用說明需使用俄語及成員國語言;
- 上市后監(jiān)督:包括不良事件報告、定期安全更新和市場監(jiān)管。
四、挑戰(zhàn)與建議
EAEU注冊制度雖簡化了多國市場準入,但法規(guī)更新頻繁,且各國實施細節(jié)可能略有差異。企業(yè)應及早規(guī)劃,與本地專家合作,確保合規(guī)。總體而言,該制度促進了歐亞區(qū)域醫(yī)療器械貿(mào)易的規(guī)范化,為全球制造商提供了重要市場機會。